Naukowcy z Wydziału Fizyki UW i Instytutu Chemii Fizycznej PAN przeprowadzili badania łączące inżynierię tkankową naczyń krwionośnych z metodami obliczeniowymi. Pozwalają one na lepsze zrozumienie i kontrolowanie angiogenezy w warunkach laboratoryjnych. Wyniki badań zostały opublikowane w czasopiśmie „APL Bioengineering”.
Jak tworzą się nowe naczynia krwionośne? Które czynniki wpływają na ten proces, zwany angiogenezą, i czy można go kontrolować zewnętrznie? Znalezienie odpowiedzi na te pytania stanowi wyzwanie zarówno dla inżynierii tkankowej, jak i terapii przeciwnowotworowej, ponieważ guzy nowotworowe wykorzystują angiogenezę do wspomagania swojego wzrostu i rozprzestrzeniania się w organizmie. Proces ten jest kluczowy dla ich przetrwania i ekspansji, gdyż umożliwia dostarczanie niezbędnych składników odżywczych i tlenu oraz usuwanie produktów przemiany materii.
Angiogeneza jest złożonym procesem, w którym migracja komórek śródbłonka jest napędzana z jednej strony przez mechanizmy fizyczne, takie jak siły adhezji międzykomórkowej i interakcje z macierzą zewnątrzkomórkową, a z drugiej strony regulowana przez biologiczne ścieżki sygnałowe. Dlatego do jej zrozumienia potrzebna jest współpraca biologów i fizyków.
Interdyscyplinarne podejście łączy wiedzę biologiczną o komórkach i molekułach z koncepcjami fizyki dotyczącymi zjawisk samoorganizacji, procesów wzrostu i transportu, co umożliwia lepsze zrozumienie i kontrolowanie angiogenezy.
Niestandardowy zestaw narzędzi
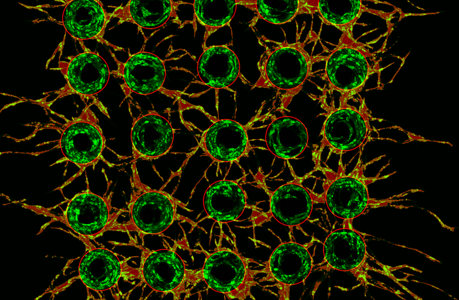
Taka współpraca została nawiązana pomiędzy naukowcami z Instytutu Chemii Fizycznej Polskiej Akademii Nauk i Wydziału Fizyki UW (prof. Piotr Szymczak, prof. Maciej Lisicki, Antoni Wrzos i Stanisław Żukowski). Przeprowadzili oni serię eksperymentów in vitro nad wczesnym wzrostem naczyń włosowatych, używając kulek pokrytych komórkami śródbłonka, umieszczonych w żelu fibrynowym. Taki układ eksperymentalny zapewnił precyzyjną kontrolę nad warunkami wzrostu, co umożliwiło uzyskanie bardziej wiarygodnych i powtarzalnych wyników.
– Jednym z kluczowych czynników, który został zbadany, był wpływ naczyniowego czynnika wzrostu śródbłonka (VEGF), kluczowej cząsteczki dla tworzenia naczyń krwionośnych. Badanie wykazało, że wyższe stężenia VEGF prowadzą do wcześniejszego i bardziej rozgałęzionego wzrostu sieci – mówi prof. Piotr Szymczak z Wydziału Fizyki UW i dodaje: – Ujawniono również ciekawe regularności w procesie tworzenia się rozgałęzień. Średni kąt pomiędzy odnogami sieci okazał się bliski 72°, co jest wartością obserwowaną także w innych sieciach transportowych w przyrodzie, takich jak sieci rzeczne, i świadczy o tym, że wzrost sieci jest regulowany przez proces dyfuzji.
Aby wesprzeć swoje odkrycia, naukowcy opracowali niestandardowy zestaw narzędzi do analizy obrazów. Oprogramowanie to może mierzyć różne parametry sieci, takie jak całkowita długość, powierzchnia, długości segmentów i kąty rozgałęzień, oferując szybkie przetwarzanie obrazów. Ten zestaw narzędzi może być cenny dla przyszłych testów leków angiogennych, dostarczając szybszych i bardziej szczegółowych informacji na temat wpływu potencjalnych terapii na wzrost naczyń. Ponadto zrozumienie dynamiki wzrostu sieci naczyń krwionośnych może pomóc w projektowaniu uprzednio unaczynionych konstruktów tkankowych, co może być ważne dla medycyny regeneracyjnej.
Rezultaty badań przeprowadzonych przez naukowców z Instytutu Chemii Fizycznej PAN oraz Uniwersytetu Warszawskiego zostały opublikowane w czasopiśmie „APL Bioengineering”.