Naukowcy z Wydziału Biologii we współpracy z badaczami z Uniwersytetu Nauki i Technologii w Hefei i Uniwersytetu w Toronto opisali strukturę przestrzenną niedawno zidentyfikowanej metylotransferazy histydynowej aktyny oraz mechanizm reakcji katalizowanej przez ten enzym. Wyniki badań zostały opublikowane w prestiżowym czasopiśmie „eLife”.
Enzymy są jednymi z najważniejszych makrocząsteczek występujących w przyrodzie. Dzięki ich aktywności w żywych organizmach mogą zachodzić reakcje chemiczne, a bez nich niemożliwe byłoby życie na Ziemi. Enzymy są obiektem badań wielu dyscyplin naukowych, a w szczególności biochemii oraz biologii strukturalnej. Pierwsza z nich zajmuje się chemicznymi podstawami funkcjonowania enzymów, natomiast druga – ich budową przestrzenną. Dzięki połączeniu sił obu możliwe jest dokładne poznanie mechanizmów działanie tych niezwykle ważnych cząsteczek.
Nowy mechanizm metylacji białek
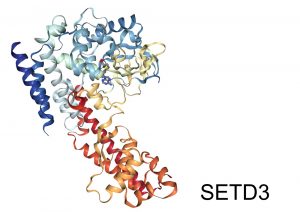
Zespół z Wydziału Biologii UW w składzie dr hab. Jakub Drożak, Sebastian Kwiatkowski i Weronika Tomaka, we współpracy z grupą badawczą prof. Chao Xu z Uniwersytetu Nauki i Technologii w Hefei w Chinach oraz prof. Jinrong Min z Uniwersytetu w Toronto w Kanadzie ustalili strukturę przestrzenną metylotransferazy histydynowej aktyny (enzym SETD3) oraz opisali nowy mechanizm metylacji białek. Metylacja histydyny jest jedną z najsłabiej poznanych modyfikacji występujących w białkach, a opublikowane wyniki stanowią istotny wkład w dotychczasową, nadal niewielką, wiedzę dotyczącą mechanizmów tego zjawiska. W świetle obserwacji, że nadprodukcja enzymu SETD3 jest skorelowana ze złośliwością niektórych nowotworów, przedstawione wyniki będą pomocne w dalszych badaniach nad rolą metylacji aktyny w procesie nowotworzenia. Autorzy przewidują, że w dalszej perspektywie możliwe będzie opracowanie drobnocząsteczkowych związków swoiście hamujących aktywność SETD3, które mogłyby znaleźć zastosowanie w terapii przeciwnowotworowej.
Metylotransferaza histydynowa aktyny
W ubiegłorocznej pracy opublikowanej w „eLife”, zespół naukowców z Wydziału Biologii UW opisał jeden z najsłabiej zbadanych enzymów kręgowców – metylotransferazę histydynową aktyny. Charakterystyka biochemiczna tego enzymu wykazała, że jest on najpewniej zaangażowany w regulację działania komórek mięśni, a zaburzenie jego właściwego funkcjonowania może stanowić ważny etap procesu nowotworzenia. Dotychczasowe badania zespołu pozwoliły poznać tożsamość oraz właściwości molekularne metylotransferazy histydynowej aktyny, otwierając obiecujące perspektywy dalszych badań. Badania zostały sfinansowane w ramach grantu Opus Narodowego Centrum Nauki.